上一頁下一頁

20171207_跑步右進_慢.mp4

Image_02366c0

Image_a0a31a8

S_7031813101070

S_7031813249015

S_7043626842572 (2)

淘寶首發買家秀33

S_7031797163354

S_7031797246191

Screenshot_20171116-105140

Screenshot_20171116-105201

Screenshot_20171116-110109

Screenshot_20171117-121522
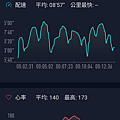
Screenshot_20171117-121533
Screenshot_20171120-102139

Screenshot_20171120-102212

Screenshot_20171120-165331
Screenshot_20171121-100220

Screenshot_20171121-100237
Screenshot_20171123-095521

Screenshot_20171123-095531

Screenshot_20171128-114910

Screenshot_20171129-171409

Screenshot_20171130-103512

Screenshot_20171130-103521

Screenshot_20171204-093841

Screenshot_20171204-093859
Screenshot_20171205-103224

Screenshot_20171205-103231
Screenshot_20171207-104658

Screenshot_20171207-104707
上一頁下一頁

HOMO/LUMO
維基百科,自由的百科全書
跳至導覽
跳至搜尋
一個分子中的HOMO和LUMO的示意圖:每個圈代表軌域中的電子;當基態分子中HOMO上的一個電子吸收了特定頻率的光線可以躍遷到LUMO上,從而成為激發態分子
HOMO和LUMO分別指最高占據分子軌域(Highest Occupied Molecular Orbital)和最低未占分子軌域(Lowest Unoccupied Molecular Orbital)。根據前線軌域理論,兩者統稱前線軌域。HOMO與LUMO之間的能量差稱為「能帶隙」,有時可以用來衡量一個分子是否容易被激發:帶隙越小,分子越容易被激發。
在有機半導體和量子點中的HOMO與無機半導體中的價帶類似,而LUMO則與導帶類似。
當分子二聚或高聚時,兩個分子的分子軌域之間的相互作用會引起HOMO與LUMO的分裂。當分子相互作用時,每一個能階分裂成彼此能量相距很小的振動能階。當有足夠的分子使得這種相互作用足夠強烈時(如在高聚物中),這些振動能階的差距變得很小,使得它們的能量幾乎可以看成是連續的。這時我們就不再叫它們能階了,而是改稱能帶。[1]
SOMO
SOMO指的是單占分子軌域(Singly occupied molecular orbital),它指的是自由基的HOMO。[2]
參見
分子軌域理論
前線軌域理論
電子組態
狄爾斯-阿爾德反應
Koopmans原理
配位基
有機半導體
原子軌域
https://en.wikipedia.org/wiki/HOMO_and_LUMO#/media/File:Molecule_HOMO-LUMO_diagram.svg
Subadjacent orbitals: NHOMO and SLUMO
If existent, the molecular orbitals at one energy level below the HOMO and one energy level above the LUMO are also found to play a role in frontier molecular orbital theory. They are named NHOMO for next-to-highest occupied molecular orbital and SLUMO for second lowest unoccupied molecular orbital.[4] These are also commonly referred to as HOMO-1 and LUMO+1, respectively.[citation needed]
See also
Diels–Alder reaction
Electron configuration
Klopman-Salem equation
Koopmans' theorem
Ligand
Organic semiconductor